WSPÓŁZALEŻNY CHARAKTER CHORÓB SERCA, NEREK I METABOLICZNYCH
ZWIĘKSZA I PRZYSPIESZA RYZYKO
ZWIĘKSZA I PRZYSPIESZA RYZYKO
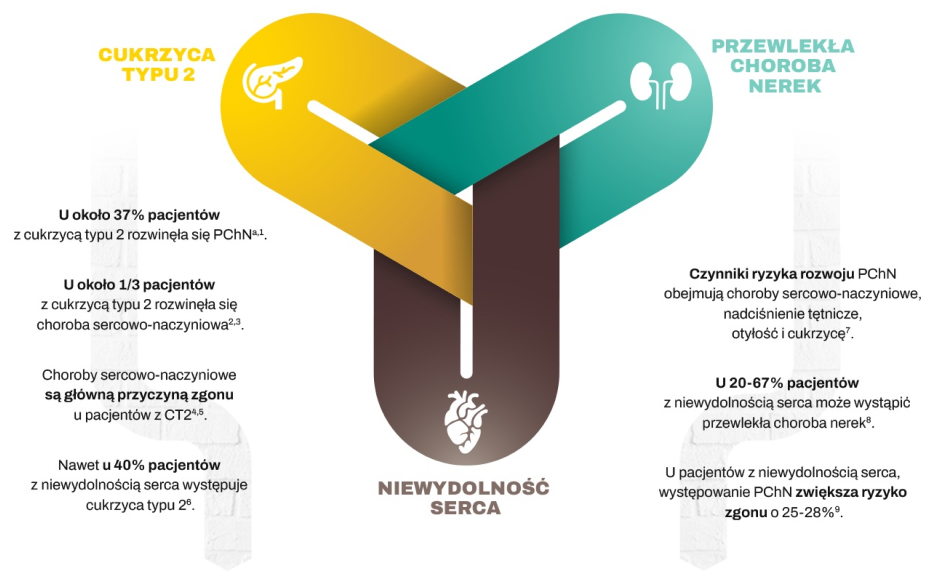
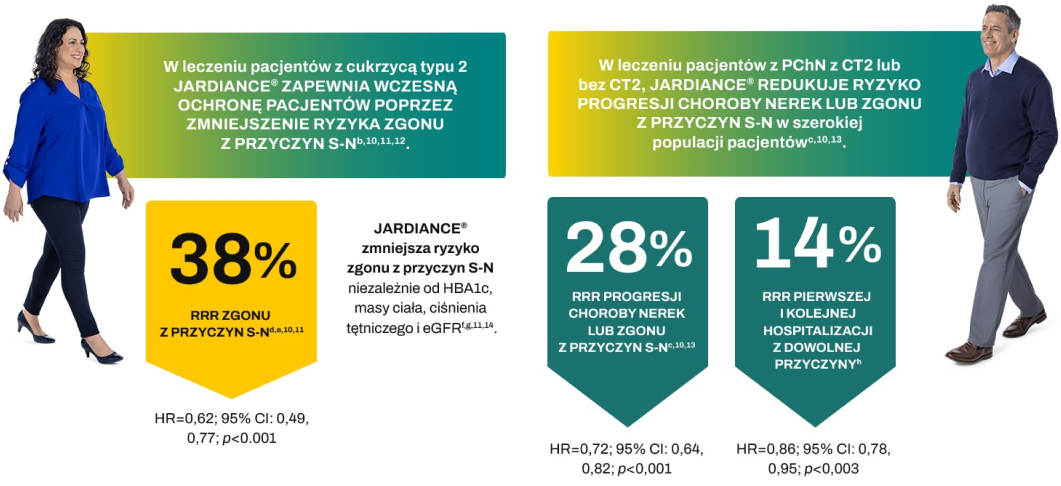
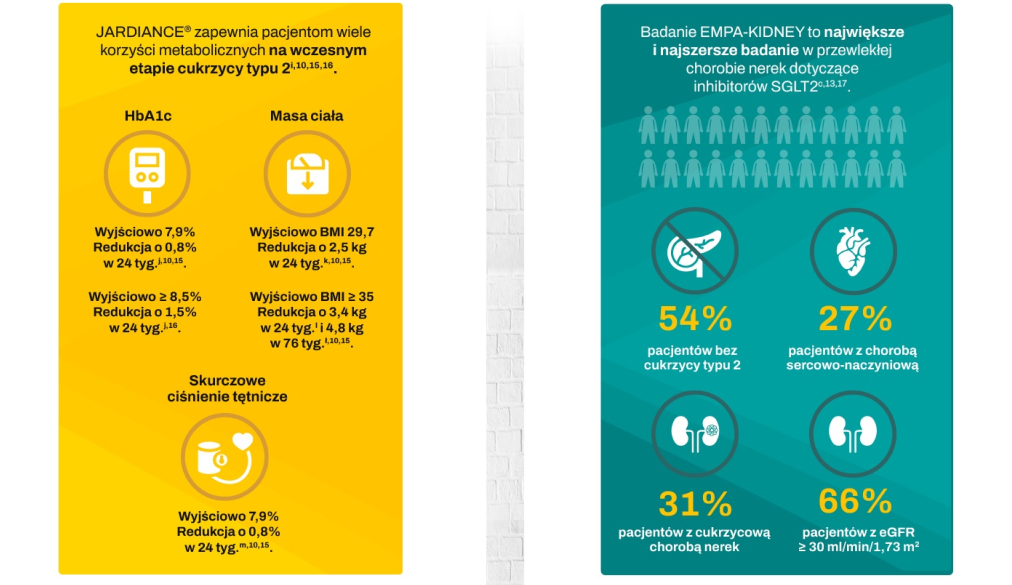

a. Według danych NHANES 2011–2012. b. Oprócz redukcji ryzyka zgonu z przyczyn S-N JARDIANCE® dołączony do standardowego leczenia obniżał również poziom HbA1c. Ponadto JARDIANCE® wykazywał działanie obniżające masę ciała i ciśnienie tętnicze. Lek JARDIANCE® nie jest wskazany do stosowania w celu uzyskania redukcji masy ciała lub obniżenia ciśnienia krwi. c. W badaniu EMPA-KIDNEY – randomizowanym, prowadzonym metodą podwójnie ślepej próby w grupach równoległych, kontrolowanym za pomocą placebo badaniu z udziałem 6609 pacjentów z PChN – oceniano skuteczność i bezpieczeństwo stosowania JARDIANCE® 10 mg (n = 3304) w porównaniu z placebo (n = 3305). Pierwszorzędowym złożonym punktem końcowym w badaniu EMPA-KIDNEY był zgon z przyczyn S-N lub progresja choroby nerek. U pacjentów leczonych JARDIANCE® odnotowano 28% RRR tego punktu końcowego (HR = 0,72; 95% CI: 0,64-0,82; p < 0,001). d. Zgon z przyczyn S-N stanowił część złożonego pierwszorzędowego punktu końcowego – 3-elementowego kryterium MACE, w badaniu EMPA-REG OUTCOME® (HR = 0,86; 95% CI: 0,74-0,99; p < 0,001 dla równoważności; p = 0,04 dla przewagi), a w ogólnej populacji badania EMPA-REG OUTCOME® osiągnięto RRR zgonu z przyczyn S-N o 38% w całym okresie badania (HR = 0,62; 95% CI: 0,49-0,77; p < 0,001). Nie stwierdzono istotnych różnic pomiędzy grupą placebo a grupami stosowania leku JARDIANCE® dotyczących występowania MI niezakończonego zgonem (HR = 0,87; 95% CI: 0,70-1,09; p = 0,22) lub udaru niezakończonego zgonem (HR = 1,24; 95% CI: 0,92-1,67; p = 0,16). e. Połączone dane dotyczące dawek 10 mg i 25 mg JARDIANCE®; dla obu dawek wykazano porównywalne obniżenie ryzyka zgonu z przyczyn S-N. f. Analiza post hoc danych pochodzących z badania EMPA-REG OUTCOME® w podgrupach utworzonych na podstawie wyjściowej wartości HbA1c. Badanie EMPA-REG OUTCOME® nie było w stanie wykazać różnic pomiędzy podgrupami. g. Współczynniki ryzyka wiążą się ze zgonami z przyczyn S-N: HbA1c < 7% (HR = 0,30; 95% CI: 0,12-0,80); HbA1c od 7% do < 8% (HR = 0,59; 95% CI: 0,42-0,83); HbA1c od 8% do < 9% (HR = 0,7; 95% CI: 0,45-0,99); HbA1c ≥ 9% (HR = 0,7; 95% CI: 0,44-1,31); p = 0,41 dla interakcji, BMI < 30 kg/m2 (HR = 0,50; 95% CI: 0,37-0,8); BMI ≥ 30 kg/m2 (HR = 0,78; 95% CI: 0,56-1,08); p = 0,05 dla interakcji. SBP ≥ 140 mmHg i/lub DBP ≥ 90 mmHg (HR = 0,5; 95% CI: 0,40-0,79); SBP < 140 mmHg i DBP < 90 mmHg (HR = 0,67; 95% CI: 0,50-0,91); p = 0,44 dla interakcji, eGFR ≥ 90 ml/min/1,73 m2 (HR = 0,70; 95% CI: 0,39-1,25); eGFR od 60 do < 90 ml/min/1,73 m2 (HR = 0,49; 95% CI: 0,35-0,68); eGFR < 60 ml/min/1,73 m2 (HR = 0,78; 95% CI: 0,54-1,12); p = 0,15 dla interakcji. h. Hospitalizacja z dowolnej przyczyny była kluczowym drugorzędowym punktem końcowym w badaniu EMPA-KIDNEY. Analiza hospitalizacji z dowolnej przyczyny obejmowała pierwsze i wszystkie kolejne zdarzenia (JARDIANCE®: 1611 hospitalizacji u 960 pacjentów; placebo: 1895 hospitalizacji u 1035 pacjentów). i. W 24-tygodniowym badaniu prowadzonym metodą podwójnie ślepej próby z kontrolą placebo, obejmującym 637 pacjentów z CT2 oceniano skuteczność i bezpieczeństwo JARDIANCE® w dawce 10 mg (n=217) i w dawce 25 mg (n=213) zastosowanego jako uzupełnienie terapii metforminą ≥1500 mg, w porównaniu z placebo w skojarzeniu z metforminą (n=207). Pierwszorzędowym punktem końcowym była skorygowana średnia zmiana stężenia HbA1c (%) (SE) w stosunku do wartości wyjściowej; utrata masy ciała stanowiła kluczowy drugorzędowy punkt końcowy, a obniżenie ciśnienia tętniczego – kluczowy eksploracyjny punkt końcowy. j. W analizie podgrup po 24 tygodniach u pacjentów z wyjściowym stężeniem ≥ 8,5%, skorygowane średnie zmiany stężeń HbA1c wyniosły: -0,5% w grupie placebo (n=50), -1,2% w grupie JARDIANCE® 10 mg (n=57) i -1,5% w grupie JARDIANCE® 25 mg (n=48). Różnica w stosunku do placebo (skorygowana średnia) wyniosła -0,73% dla JARDIANCE® w dawce 10 mg i -1,0% dla JARDIANCE® w dawce 25 mg. k. Skorygowane średnie zmiany masy ciała, odpowiednio o -0,45 kg w stosunku do wartości wyjściowej 79,7 kg w grupie placebo (n=207), -2,08 kg w stosunku do wartości wyjściowej 81,6 kg w grupie JARDIANCE® 10 mg (n=217) i -2,46 kg w stosunku do wartości wyjściowej 82,2 kg w grupie JARDIANCE® 25 mg (n=213), p<0,0001 wobec placebo dla obu dawek. l. W analizie podgrup po 24 tygodniach u pacjentów z wyjściową wartością BMI ≥35, skorygowane średnie zmiany masy ciała wyniosły: -0,35 kg w grupie placebo (n=29), -2,63 kg w grupie JARDIANCE® 10 mg (n=33) i -3,36 kg w grupie JARDIANCE® 25 mg (n=41). Różnica w stosunku do placebo (skorygowana średnia) wyniosła -2,28 dla JARDIANCE® w dawce 10 mg i -3,01 dla JARDIANCE® w dawce 25 mg. ł. W badaniu przedłużonym prowadzonym metodą podwójnie ślepej próby skorygowana średnia zmiana masy ciała u pacjentów z wyjściową wartością BMI ≥ 35 wyniosła w tygodniu 76 0,23 kg w grupie placebo (n=29), -3,74 kg w grupie JARDIANCE® 10 mg (n=33) i -4,77 kg w grupie JARDIANCE® 25 mg (n=41). Różnica w stosunku do placebo (skorygowana średnia) wyniosła -3,96 kg dla JARDIANCE® w dawce 10 mg i -4,99 kg dla JARDIANCE® w dawce 25 mg. m. Skorygowane średnie zmiany, odpowiednio, o -0,1% w stosunku do poziomu wyjściowego HbA1C 7,9% w grupie placebo (n=207), o -0,7% w stosunku do poziomu wyjściowego 7,9% HbA1C w grupie JARDIANCE® 10 mg (n=217) i o -0,8% w stosunku do poziomu wyjściowego 7,9% w grupie JARDIANCE® 25 mg (n=213). Różnica między grupą placebo a grupami otrzymującymi JARDIANCE® zarówno w dawce 10 mg, jak i w dawce 25 mg (skorygowana średnia) wynosiła -0,6%; p<0,001 wobec placebo dla obu dawek. n. Dorośli pacjenci z przewlekłą niewydolnością serca (klasy II, III lub IV wg NYHA) i obniżoną frakcją wyrzutową (LVEF ≤ 40%). o. Dorośli pacjenci z przewlekłą niewydolnością serca (klasy II, III lub IV wg NYHA) i zachowaną frakcją wyrzutową (LVEF > 40%). p. W badaniu EMPEROR-Reduced – randomizowanym, prowadzonym metodą podwójnie ślepej próby w grupach równoległych, kontrolowanym za pomocą placebo badaniu z udziałem 3730 pacjentów z HFrEF – oceniano skuteczność i bezpieczeństwo stosowania JARDIANCE® 10 mg (n = 1863) w porównaniu z placebo (n = 1867). Pacjentami były osoby dorosłe z przewlekłą niewydolnością serca (klasy II, III lub IV wg NYHA) i obniżoną frakcją wyrzutową (LVEF ≤ 40%). Pierwszorzędowym złożonym punktem końcowym w badaniu EMPEROR-Reduced był zgon z przyczyn S-N lub HHF, analizowane jako czas do pierwszego zdarzenia. U pacjentów leczonych JARDIANCE® odnotowano 25% RRR tego punktu końcowego (HR = 0,75; 95% CI: 0,65-0,86; p < 0,001). W badaniu EMPEROR-Preserved – randomizowanym, prowadzonym metodą podwójnie ślepej próby w grupach równoległych, kontrolowanym za pomocą placebo badaniu z udziałem 5988 pacjentów z HFpEF – oceniano skuteczność i bezpieczeństwo stosowania JARDIANCE® 10 mg (n = 2997) w porównaniu z placebo (n = 2991). Pacjentami były osoby dorosłe z przewlekłą niewydolnością serca (klasy II, III lub IV wg NYHA) i zachowaną frakcją wyrzutową (LVEF > 40%). Pierwszorzędowym złożonym punktem końcowym w badaniu EMPEROR-Preserved był zgon z przyczyn S-N lub HHF, analizowane jako czas do pierwszego zdarzenia. U pacjentów leczonych JARDIANCE® odnotowano 21% RRR tego punktu końcowego (HR = 0,79; 95% CI: 0,69-0,90; p < 0,001).
CAD – choroba wieńcowa. CI – przedział ufności. CT2 – cukrzyca typu 2. PChN – przewlekła choroba nerek. S‑N – sercowo-naczyniowy. PAD – choroba tętnic obwodowych. MACE – poważne niepożądane zdarzenie sercowo-naczyniowe. iSGLT2 – inhibitor kotransportera sodowo-glukozowego 2. RRR – względna redukcja ryzyka. MI – zawał mięśnia sercowego. HR – iloraz ryzyka. LVEF – frakcja wyrzutowa lewej komory.
1. Murphy D, et al. Ann Intern Med. 2016;165:473. 2. Einarson TR, et al. Cardiovasc Diabetol. 2018;17:83. 3. International Diabetes Federation. IDF Diabetes Atlas. 9th edn. 2019. https://www.diabetesatlas.org/ (accessed August 2020). 4. Morrish NJ, et al. Diabetologia. 2001;44(Suppl. 2):S14. 5. American Diabetes Association. Diabetes Care. 2020;43:S1. 6. Thomas MC, et al. Curr Cardiol Rev. 2016;12:249. 7. Siemens Healthineers. Chronic kidney disease: a global crisis. 2018. www.siemens-healthineers.com/en-uk/news/chronic-kidney-disease.html (accessed Aug 2020). 8. Sarraf M, et al. Clin J Am Soc Nephrol. 2009;4:2013. 9. Ather S, et al. J Am Coll Cardiol. 2012;59:998. 10. Charakterystyka produktu leczniczego JARDIANCE® z dnia 10.02.2025 r. 11. Zinman B, et al. EMPA REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373(22):2117-2128. 12. Fitchett D, et al. EMPA REG OUTCOME Investigators. Cardiovascular mortality reduction with empagliflozin in patients with type 2 diabetes and cardiovascular disease. J Am Coll Cardiol. 2018;71(3):363-369. 13. Herrington WG, et al. EMPA KIDNEY Collaborative Group. Empagliflozin in patients with chronic kidney disease. N Engl J Med. 2023;388(2):117-127. 14. Inzucchi SE, et al. Improvement in cardiovascular outcomes with empagliflozin is independent of glycemic control. Circulation. 2018;138(17):1904-1907. 15. Häring HU, et al. EMPA REG MET Trial Investigators. Empagliflozin as add on to metformin in patients with type 2 diabetes: a 24 week, randomized, double blind, placebo controlled trial. Diabetes Care. 2014;37(6):1650-1659. 16. Inzucchi SE, et al. Empagliflozin treatment effects across categories of baseline HbA1c, body weight, and blood pressure as an add on to metformin in patients with type 2 diabetes. Diabetes Obes Metab. 2021;23(2):425-433. 17. EMPA-KIDNEY full data presentation, presented on 4 November 2022 at the American Society of Nephrology (ASN) Congress 2022 - Kidney Week. 18. GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2020;395(10225):709-733. 19. McDonagh TA, et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726. 20. Davies MJ, et al. Management of hyperglycemia in type 2 diabetes, 2022: a consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022;45(11):2753-2786. 21. Heidenreich PA, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Acad Cardiol 2022;79(17):e263-e421. 22. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2013;3(1):1-150. 23. Packer M, et al. EMPEROR Reduced Trial Investigators Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020;383(15):1413-1424. 24. Anker SD, et al. EMPEROR Preserved Trial Investigators. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med. 2021;385(16):1451-1461.
